Американское Управление по контролю за продуктами и лекарствами на данный момент одобрило Qsymia (фентермин и topiramate расширенный выпуск) как дополнение к диете и упражнениям сниженной калории для хронической оптимизации веса.Лекарственное средство одобрено для применения во взрослых с индексом массы тела (BMI) 30 или больше (страдающий ожирением), или взрослых с BMI 27 или больше (избыточный вес), у кого имеется по крайней мере одно связанное с весом условие, такое как громадное кровяное давление (артериальная гипертензия), диабет 2 типа или громадный холестерин (дислипидемия).BMI, измеряющий жировую прослойку на базе веса и высоты человека, употребляется, чтобы узнать ожирение и грузные категории.
По данным Центров по контролю и профилактике заболеваний, больше чем одна треть взрослых В США имеется страдающей ожирением.«Ожирение угрожает полному замечательно быть больных и имеется главной проблемой здравоохранения», сказала Джанет Вудкок, Доктор медицины, директор Центра FDA Лекарственного средства и Оценки Исследования. «Qsymia, используемый ответственно в сочетании со здоровым образом судьбы, включающим упражнения и диету сниженной калории, предоставляет второй вариант лечения хронической оптимизации веса в американцах, каковые являются страдающими ожирением или весят больше нормы и имеют по крайней мере одно связанное с весом смертельное условие».Qsymia имеется комбинацией двух одобренных FDA препаратов, фентермина и topiramate, в рецептуре расширенного выпуска. Фентермин обозначен для кратковременной потери веса в толстых или страдающих ожирением взрослых, осуществляющих и едящих сниженную диету калории.
Topiramate обозначен, чтобы лечить определенные типы приступов у людей, у которых имеется эпилепсия и не допустить мигрени.Qsymia не должен употребляться в течении беременности, по обстоятельству того, что это может повредить плод . Эти показывают, что плод, которому подвергают topiramate, компонента Qsymia, в начальный триместр беременности, имеет повышенный риск оральных расселин (заячья губа с или без волчьей пасти). Женщины, каковые в состоянии воспроизвести, не должны быть беременными при старте терапии Qsymia или забеременеть при взятии Qsymia. Женщины репродуктивного потенциала должны иметь отрицательный тест на беременность прежде, чем начать Qsymia и каждый месяц при применении лекарственного средства и должны последовательно использовать действенную контрацепцию при взятии Qsymia.
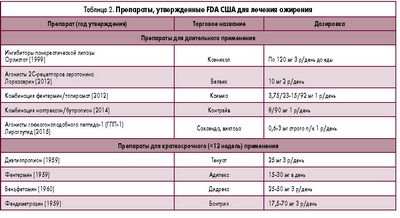
Безопасность и эффективность Qsymia была оценена в двух рандомизированных, контролируемые изучения плацебо, включавшие приблизительно 3 700 страдающих ожирением и толстых больных с и без громадных связанных с весом условий; их лечили в течение одного года. Все больные забрали модификацию образа судьбы, складывавшуюся из сниженной диеты калории и регулярной физической активности.Рекомендуемая дневная доза Qsymia содержит 7,5 миллиграммов фентермина и 46 мг topiramate расширенного выпуска. Qsymia также недорог в более высокой дозе (фентермин на 15 мг и 92 мг topiramate расширенного выпуска) для избранных больных.
Результаты этих двух опробований показывают, что по окончании одного года лечения с рекомендуемой и самой высокой дневной дозой Qsymia, у больных была средняя потеря веса 6,7 процентов и 8,9 процентов, соответственно, по лечению с на данный момент. Приблизительно 62 процента и 69 процентов больных потеряли по крайней мере пять процентов собственного веса тела с рекомендуемой дозой, и самая высокая доза Qsymia, соответственно, в случае если сравнивать с приблизительно 20 процентами больных отнеслась с плацебо.Больные, не потерявшие по крайней мере три процента их веса тела к семь дней 12 из лечения с Qsymia, вряд ли достигнут и выдержат потерю веса с продолжительным лечением в данной дозе.
Исходя из этого реакция на терапию с рекомендуемой дневной дозой Qsymia должна быть оценена на 12 недель, чтобы узнать, на базе суммы потери веса, прекратить ли Qsymia или увеличиться до более высокой дозы. Если по окончании 12 недель на более высокой дозе Qsymia, больной не теряет по крайней мере пять процентов веса тела, то Qsymia должен быть прекращен, вследствие того что эти больные вряд ли достигнут клинически значащей потери веса с продолжительным лечением.
Если не предписать QsymiaQsymia не должен употребляться у больных с глаукомой или гипертиреозом. Qsymia может увеличить частоту сердечных сокращений; эффект этого лекарственного средства на частоту сердечных сокращений у больных в высоком риске для сердечного приступа или инсульта не известен.
Исходя из этого использование Qsymia у больных с недавним (в течение прошлых шести месяцев) или нестабильная заболевание сердца или инсульт не рекомендуется. Регулярный контроль частоты сердечных сокращений рекомендуется для всего взятия больных Qsymia, в особенности при старте Qsymia или увеличении дозы.
FDA одобрила Qsymia со Стратегией Оценки и Смягчения Риска (rem), что складывается из Экскурсовода Лечения, информирующего больным о важной информации о безопасности и элементах снабжать надёжное использование, каковые включают обучение врача, выписывающий лекарства и сертификацию аптеки. Цель rem пребывает в том, чтобы научить врачей, выписывающий их лекарства и пациентов о повышенном риске врожденных недочётов, каковые связаны с первым выделением триместра к Qsymia, потребности в профилактике и потребности беременности прекратить терапию, если беременность происходит. Qsymia будет только распределен через собирается сертифицированные аптеки.
Vivus Inc. будет обязана проводить 10 постмаркетинговых изучений, включая долгосрочное сердечно-сосудистое опробование результатов, чтобы оценить эффект Qsymia на риске для главных негативных кардиальных событий, таких как сердечный приступ и инсульт.Самый распространенные побочные эффекты Qsymia покалывают рук и ног (парестезия), головокружение, поменянное чувство вкуса, бессонница, запор и ксеростомия.
Qsymia реализован Vivus Inc. в Маунтин-Вью, Калифорния.